(R)-3-羟基丁酸(R-3HB)是一种重要的手性化合物,因其独特的手性性质和生理生物学特性,成为药物和精细化工生产的重要中间体,在食品、农业、医药、精细化学品等领域得到了广泛的应用。同时,R-3HB也是聚(3-羟基丁酸)(P3HB)的单体。P3HB具有与聚丙烯相似的特性,并且可以在各种环境条件下迅速生物降解,因此P3HB是目前最具吸引力的一种可降解生物塑料。
R-3HB的生物合成法主要有两种方式:一种是以乙酰辅酶A为底物先合成P3HB,然后通过酶催化将其解聚成R-3HB。该方法由于降解过程成本高且复杂,不适合工业应用。另一种方法是通过β-酮硫解酶、乙酰乙酰辅酶A还原酶催化乙酰辅酶A合成(R)-3-羟基丁酰辅酶A(R-3HB-CoA),再通过辅酶A的去除来直接合成R-3HB。近年来R-3HB生物合成的研究主要聚焦于直接合成法。以往报道的利用直接法合成R-3HB的最高产量为16.3 g/L, 低的合成效率无法满足大规模工业化生产的需求。
鉴于此,本项目首先通过筛选硫脂酶的种类,构建了β-酮硫解酶(PhaA)、乙酰乙酰辅酶A还原酶(PhaB)和硫脂酶(TesB)催化合成R-3HB的直接途径。随后通过优化关键酶PhaA和PhaB的活性,提高辅因子NADPH的供应以及全局性中心碳代谢调控三管齐下的策略,显著提升了R-3HB的合成效率,最终构建的工程菌株Q5081在单批补料发酵中R-3HB的产量达到75.7 g/L,生产效率率1.26 g/L/h,转化率为0.34 g/g葡萄糖,这是迄今为止报道的R-3HB的最高产量和生产效率。此外,我们通过转录组测序和分析阐明了工程菌株提高R-3HB生物合成的机制。经过系统的代谢调控策略,工程菌株的副产物合成路径下调,乙醛酸循环途径上调,辅因子NADPH的合成路径明显增强,这些变化能够保障R-3HB合成过程的辅因子供应,提高碳原子的经济性。
R-3HB作为一种重要的生物基平台化合物,具有广泛的应用前景。本研究采用三管齐下的系统代谢工程调控策略,显著提高了R-3HB的生物合成,为R-3HB的大规模工业化生产和应用提供了新的思路和方法。
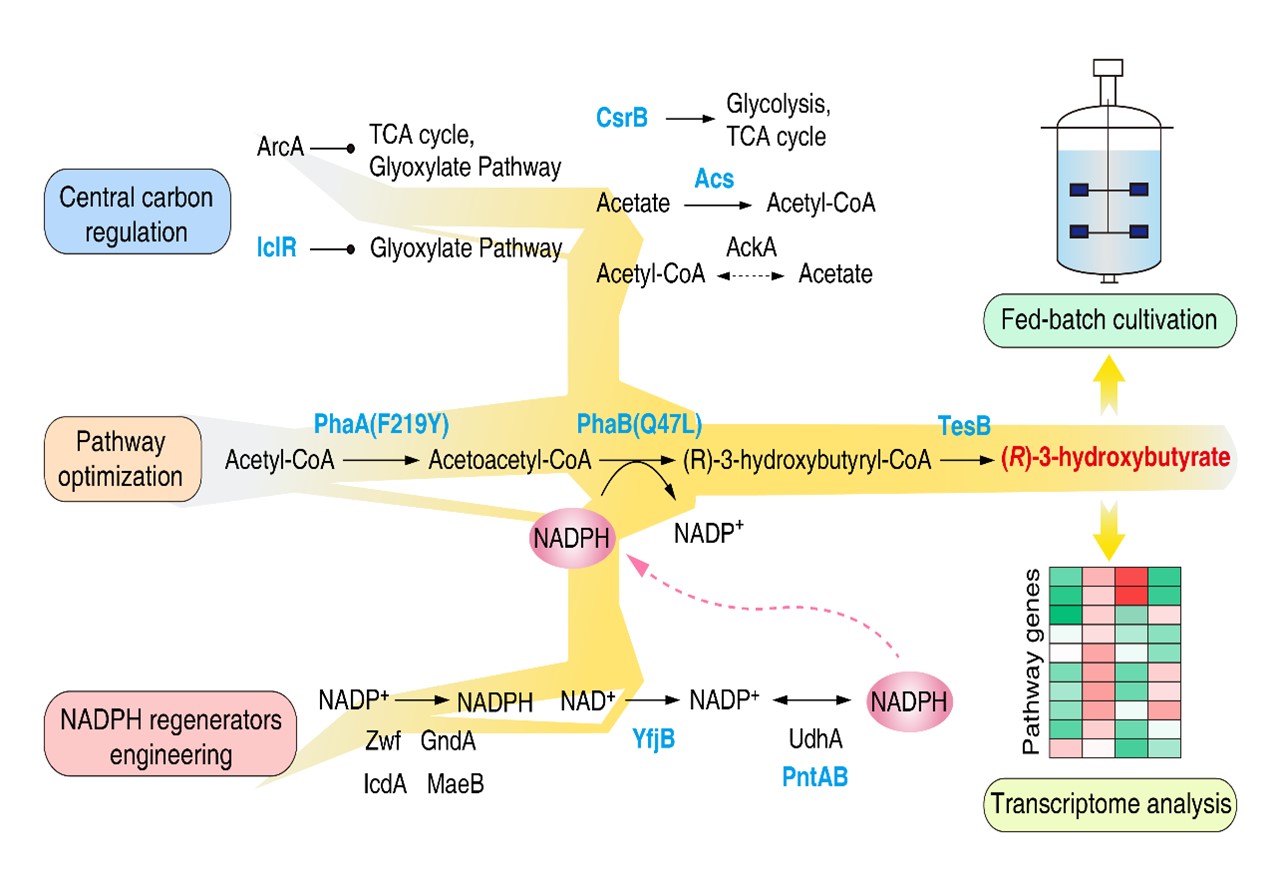
图 三管齐下的系统代谢工程策略提高R-3-羟基丁酸的生物合成
山东大学微生物技术国家重点实验室为论文第一完成单位和通讯作者单位,赵广教授和刘敏副研究员为论文通讯作者,硕士研究生陈金鸿和博士研究生郭李坤为论文的共同第一作者。该研究工作得到了国家重点研发计划、国家自然科学基金、国重室创新群体等项目的资助。
论文链接:https://doi.org/10.1021/acs.jafc.4c04123